- 首頁(yè) >> 科技服務(wù) >> 工作動(dòng)態(tài)
工作動(dòng)態(tài)
RNA病毒包括多種致病病原,對(duì)人類(lèi)健康構(gòu)成嚴(yán)重威脅。RNA病毒的基因組復(fù)制和轉(zhuǎn)錄過(guò)程需要自身編碼的依賴RNA的RNA聚合酶(RNA-dependent RNA polymerase, RdRP)來(lái)主導(dǎo)完成,該過(guò)程經(jīng)歷引發(fā)(initiation)、延伸(elongation)和終止(termination)階段,由數(shù)以千計(jì)的核苷酸添加循環(huán)(nucleotide addition cycle,NAC)組成。該循環(huán)的機(jī)制不僅是了解RNA病毒本質(zhì)特征的重要內(nèi)容,也是發(fā)展針對(duì)RdRP的抗病毒策略的重要依據(jù)。關(guān)于病毒RdRP的現(xiàn)有研究表明,每個(gè)NAC經(jīng)歷四個(gè)步驟:1. 反應(yīng)底物NTP進(jìn)入RdRP活性中心;2. RdRP活性中心關(guān)閉(active site closure);3. 核苷酸轉(zhuǎn)移(nucleotidyl transfer)反應(yīng)發(fā)生(產(chǎn)物RNA的3’-末端添加一個(gè)核苷酸);4. RdRP向下一位模板核苷酸轉(zhuǎn)位(translocation)從而開(kāi)啟下一輪循環(huán)。過(guò)去十余年間,結(jié)構(gòu)生物學(xué)與酶學(xué)研究已基本完整勾勒出該NAC的機(jī)制,但始終未能準(zhǔn)確獲得催化反應(yīng)(步驟3)即將發(fā)生時(shí)的RdRP結(jié)構(gòu)信息,因此對(duì)于哪些氨基酸殘基在催化反應(yīng)中發(fā)揮關(guān)鍵作用仍存在爭(zhēng)議。
中國(guó)科學(xué)院武漢病毒研究所龔鵬研究員團(tuán)隊(duì)長(zhǎng)期從事病毒RdRP催化機(jī)制研究,近期該團(tuán)隊(duì)通過(guò)在腸道病毒71型(enterovirus 71,EV71)RdRP-RNA復(fù)合物晶體浸泡實(shí)驗(yàn)中的多方嘗試,成功解析了高度接近催化反應(yīng)發(fā)生狀態(tài)的RdRP晶體結(jié)構(gòu)(圖A,PDB編號(hào):7W9S,分辨率2.5埃),發(fā)現(xiàn)位于RdRP基序D附近的一個(gè)賴氨酸殘基K360與結(jié)構(gòu)中底物CTP的g-磷酸存在近距離相互作用(3.3埃)。在與EV71同為腸道病毒的脊髓灰質(zhì)炎病毒的前期研究中,等同的K359殘基被認(rèn)為直接參與了催化反應(yīng)和其中的質(zhì)子轉(zhuǎn)移過(guò)程,而上述晶體結(jié)構(gòu)中觀測(cè)到的近距離相互作用進(jìn)一步提示了這種可能性。據(jù)此,該團(tuán)隊(duì)選取了EV71 RdRP的K360殘基和另一個(gè)與CTP的磷酸基團(tuán)存在相互作用的基序F精氨酸殘基R174為突變位點(diǎn)設(shè)計(jì)了系列突變體,利用酶學(xué)方法對(duì)野生型RdRP和突變體的單步延伸速率常數(shù)和CTP米氏常數(shù)(圖B)、RdRP延伸狀態(tài)(elongation)和延伸前狀態(tài)(pre-elongation)下催化的pH依賴性等多種參數(shù)和性質(zhì)進(jìn)行了表征。結(jié)果表明,K360位點(diǎn)的突變不僅降低了催化效率而且在延伸和延伸前狀態(tài)下都能影響RdRP的pH依賴特性,而R174位點(diǎn)的突變所造成的影響與K360類(lèi)似且能額外降低底物CTP的親和力。這些數(shù)據(jù)表明K360和R174都直接參與催化反應(yīng),但這兩個(gè)殘基是否直接參與質(zhì)子轉(zhuǎn)移仍有待進(jìn)一步取證。這項(xiàng)工作是該團(tuán)隊(duì)繼解析RdRP活性中心部分關(guān)閉結(jié)構(gòu)(對(duì)應(yīng)NAC步驟2)和揭示不對(duì)稱(chēng)轉(zhuǎn)位現(xiàn)象(對(duì)應(yīng)NAC步驟4)(PNAS 2016;Nature Communications 2020)等NAC系列工作后的又一項(xiàng)成果(對(duì)應(yīng)NAC步驟3),闡明了該循環(huán)的全過(guò)程機(jī)制(圖C和動(dòng)圖)。
相關(guān)論文近期在線發(fā)表于Nucleic Acids Research(《核酸研究》),此項(xiàng)研究受到國(guó)家重點(diǎn)研發(fā)計(jì)劃項(xiàng)目(2018YFA0507200,項(xiàng)目負(fù)責(zé)人為陳新文研究員)、國(guó)家自然科學(xué)基金項(xiàng)目(32070185)、湖北省江夏實(shí)驗(yàn)室生物安全科技重大項(xiàng)目(JXBS001)等的支持。武漢病毒所博士研究生/博士后李瑞(2021年獲得博士學(xué)位,主要完成酶學(xué)研究)和博士研究生王美華(2021年獲得博士學(xué)位,主要完成結(jié)構(gòu)生物學(xué)研究)為論文的共同第一作者,龔鵬研究員為論文的通訊作者。
論文及前續(xù)系列論文鏈接為:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkac1133/6882138
https://www.nature.com/articles/s41467-020-16234-4
https://www.pnas.org/doi/epdf/10.1073/pnas.1602591113
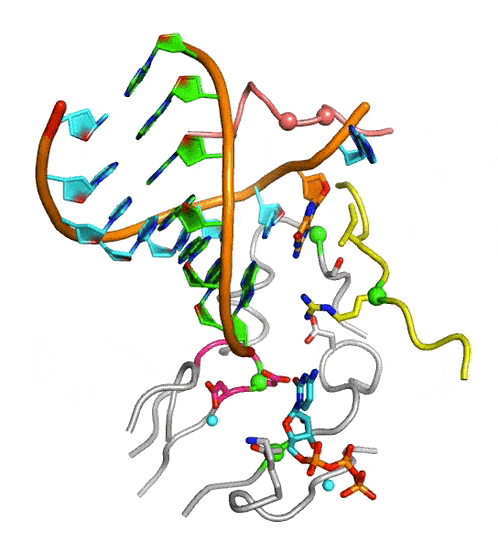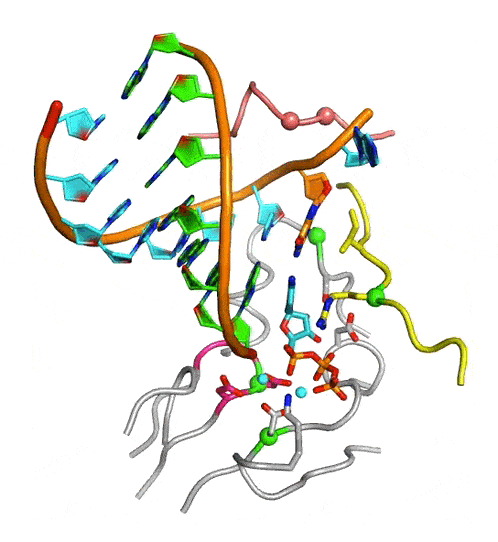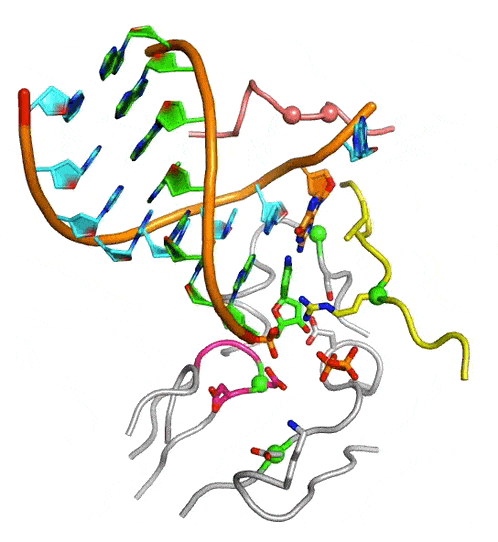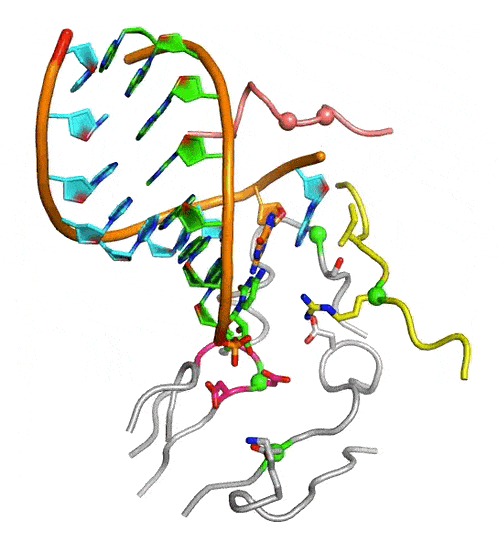
病毒RdRP完整NAC動(dòng)圖
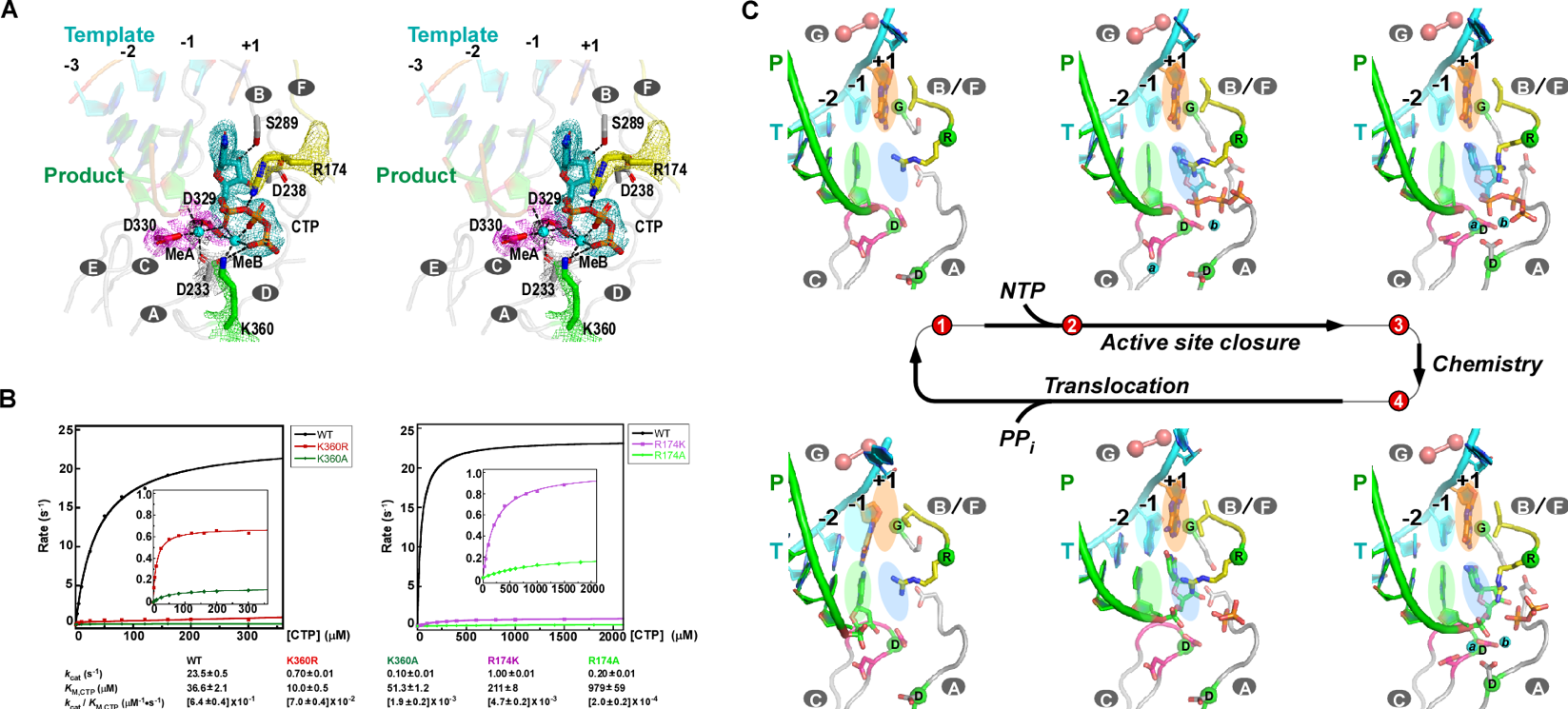
圖:病毒RdRP核苷酸添加循環(huán)新機(jī)制。A)接近催化反應(yīng)發(fā)生狀態(tài)的EV71 RdRP晶體結(jié)構(gòu)立體對(duì)像圖。B)K360和R174位點(diǎn)的突變大幅降低RdRP催化效率。C)病毒RdRP核苷酸添加循環(huán)(NAC)的完整結(jié)構(gòu)基礎(chǔ),圖中參考狀態(tài)1-4之間的轉(zhuǎn)換過(guò)程1-2、2-3、3-4和4-1分別對(duì)應(yīng)NAC步驟1、2、3和4。A和C中的RdRP基序用白色大寫(xiě)字母標(biāo)注。

 科技服務(wù)
科技服務(wù)